2019.01.24

痩せると病気になって早く死ぬという自然の摂理――最新の医学データが示すダイエットの真実(3)
痩せて健康なはずがない
痩せすぎ、太り過ぎは、BMIという指数で判断されることを前に説明しました。一般的にBMIが18.5未満となると痩せすぎで、BMIが17.5以下が神経性やせ症の診断基準です。人間がもっとも長寿なBMIは、日本人では23~25です(Sasazuki, et al, 2011)。さらにAfzal博士ら(Afzal, et al., 2016)は、もっとも長寿である体重(BMI)がデンマークでは上昇しており、現在27.0と、通常、太りすぎや日本では肥満とされる体重となっていることをが報告しています(後で詳述します)。
ところが、次回以降で詳述するように、現在、多くの日本の若年女性が痩せすぎなのです。20~29歳女性の22.3%、30~39歳女性の15.5%が、BMIが18.5未満で痩せすぎでした(永田利彦 ほか 2018, 健康局健康課栄養指導室栄養調査係, 2016)。一方で、BMIが25以上で太りすぎである割合は、20~29歳女性の10.2%、30~39歳女性の6.6%です。
健康的な体重であっても自分自身のことを太っていると感じ、7割もの若年女性が、世界で一番ダイエットに励んでいるのが日本です(Wardle, et al., 2006)。いうなれば、多くの日本の若年女性が、自分から不健康になるように努力しているのです。
神経性やせ症と診断されない程度の痩せすぎでも、明らかに身体的・精神的な悪影響があります。しかしそれらの悪影響は、どれも長期的なものばかりで、短期間な悪影響は限定的であることから、見た目重視の人々からは軽視されてきました。
精神的には、空腹によって食物に過度に囚われ、倦怠感、注意散漫、焦燥を生じます。身体的には、無月経、不妊に加えて、妊婦の低体重化、低出生体重児の増加、骨減少症、将来的な骨粗鬆症の危険性があります(Canadian Paediatric Society, 2004)。
図1.骨量のライフサイクル(Weaver C. et al. (2016)を改編)
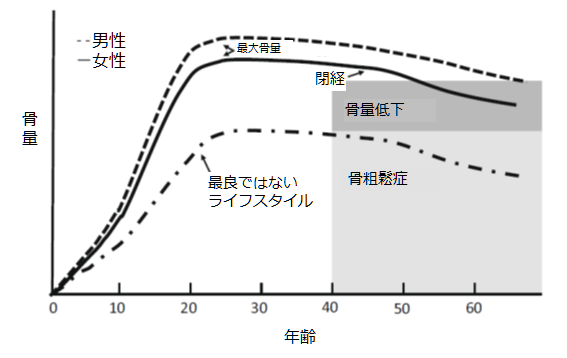
人間の骨量は、20歳前後に最大(すなわち最大骨量、Peak Bone Mass)に達し、その後は徐々に骨量が低下し続け、閉経を経て40歳以降に骨粗鬆症を発症します(Weaver, et al, 2016)。ですので、中年以降に骨粗鬆症となるかどうかは、20歳前後に高い最大骨量、どれだけ骨量を貯めておけたかが重要です(Weaver et al, 2016)。
普通の健康な若い女性にとっては、カルシウム摂取量や身体的な運動量が重要です。しかし、痩せすぎの人にとっては、それ以前の問題として、低栄養状態や無月経などの方が問題となります(Weaver et al, 2016)。20歳でダイエットのしすぎで体重減少性無月経となることは、通常ではあり得ない閉経を若年に迎えるのと同じです。事実、神経性やせ症の患者では、骨折が多発しています(Nagata, et al, 2003; 河原田洋次郎 ほか, 2000)。
その背景には病的な骨量の低下があります(Iketani, et al, 2003)。体重減少による無月経では、当然のことながら体重回復が重要で、BMIが19を超えることが月経再開に重要です(丸山史, ほか, 2000)。女性ホルモン補充によって、たしかに子宮の機能が回復し月経が再開されますが、総摂取カロリーが低いままなら、心臓、腎臓、脳といった重要な臓器に供給されていたエネルギーが子宮に回るだけなのです。痩せると脳や心臓も痩せていることが報告されています。
図2.低出生体重児の増加 (瀧本秀美 ほか, 2010 を改編)
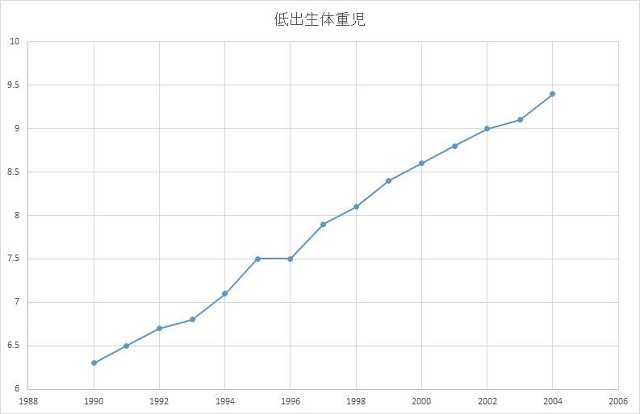
さらに見逃せないのが、低出生体重児の問題です。低出生体重児は、出生時体重が2500g未満であることで、その率は、発展途上国支援で健康改善効果の指標とされてきました。そうです、通常は衛生状態や国の豊かさの指標なのです。
図2に日本での低出生体重児の割合を示しています。第二次世界大戦後の1951年には、男児の6.4%、女児の8.3%が低出生体重児でありましたが、社会が豊かになるにつれて、1980年には男児の4.8%、女児の5.6%まで低下しました。それが、2005年には男児の8.5%、女児の10.6%と倍増しました(瀧本秀美, ほか, 2010)。この低出生体重児増加が医療環境の問題でないのは明らかです。反対に格段に良くなっていることが各種の指標によって明らかにされています。
例えば乳児死亡率は、1950年の日本では1000回の出生当たり60.1でありましたが、2008年には2.6と20分の1以下に激減しました。これは日本の医療がどれほど優秀かを表しています。イギリスの1000回の出生当たり5.6と比べて2分の1以下なのですから。
低出生体重児増加の原因として喫煙率も関連しますが、妊婦のエネルギー摂取不足、すなわち若年女性の痩せすぎの影響は明らかです(Han, et al, 2011)。日本の若年女性は太ることを恐れて、妊婦たちが赤ちゃんのために必要なエネルギーを十分に摂取していないのです(永田利彦ほか, 2018)。
妊娠中期、後期の摂るべき1日のエネルギー摂取量(厚生労働省の通常活動レベル推奨エネルギー摂取量)は、それぞれ2300カロリー、2520カロリーです。ところが、浜松医科大学Kubota先生らの調査では、実際の摂取カロリーは1600カロリーを下回っていました(Kubota, et al, 2013)。この研究では、浜松市に在住の妊婦245名を対象に、妊娠初期、中期、後期を通じて、食事をデジタルカメラで撮影してもらい、それを解析したのです。すると、妊娠後期になると摂取カロリーも増やさないといけないのに、ずっと1600カロリーを下回ったままだったのです。これは厚生労働省推奨値を37%も下回っていました(Kubota et al, 2013; 伊東, 2015)。
この状況を受けて、2006年に「妊産婦のための食生活指針」が改訂され、それまでの妊婦の太りすぎだけではなく、痩せすぎへの注意喚起がされるようになりました。しかし、この10年間、低出生体重児の率は横ばいで、2014年には男児は8.4%、女児は10.7%と高止まりしたままなのです。
低出生体重児は、数々の神経学的・身体的合併症を伴います。新生児時期の持続性高インシュリン性低血糖症などが怖いです。幼児期~青年期に問題となるSGA(small for gestational age)性低身長症などをはじめ、悪影響は、呼吸・循環・血液・神経・消化管・腎臓・内分泌と全身の隅々にわたります。
さらに低出生体重児で生まれたことの悪影響は、生涯にわたって続きます。そう、生活習慣病につながるのです。Barker仮説・胎児プログラミング仮説というのがあります(Barker & Osmond, 1986)。Barker博士らは、出生時体重が低いほど、心血管系疾患によって死亡する率が高いことを報告しました(Barker, Winter, Osmond, Margetts & Simmonds, 1989)。
子宮内で低栄養に曝された胎児は、出生体重が低いだけではなく、環境に適合するための体質変化が生じ(エネルギーをためこみやすい体質、省エネ体質、倹約体質、thrifty phenotypeに変化する)、出生後に栄養環境が改善し飽食環境となると相対的な過栄養状況となるため、肥満やメタボリックシンドロームとなりやすいとしました。
胎児期および生後早期の環境によって、感受期にさまざまな器官がプログラミングされ、成人期に慢性疾患を発症します。しかし、低出生体重児とならないような場合でも、生活習慣病のリスクがあることや、何世代も持続することが説明できませんでした。
母親が妊娠中に第二次世界大戦前後の飢餓を経験し、子宮内発育遅延児Small-for-Gestational-Age、SGAとなったとき、成人になった後に高率で生活習慣病となることが明らかとなりました(Gluckman & Hanson, 2004)。これを受けて、Gluckman博士とHanson博士は、胎児プログラミング仮説をさらに一般化して、受精前の環境因子、胎芽期、胎生期、乳幼児期、学童期のさまざまな環境因子が、成人期や老年期の健康、そして非感染性疾患(Non-Communicable Diseases)リスクとなるとしました。
「発達過程(胎児期や生後早期)におけるさまざまな環境により、その後の環境を予測した適応反応(predictive adaptive response)が起こり、そのおりの環境とその後の環境との適合の程度が将来の疾病リスクに関与する」、Developmental Origins of Health and Disease (DOHaD)学説を提唱するに至り(Gluckman & Hanson, 2004)、これが広く受け入れられつつあります。
そして、恐ろしいことに、低出生体重児など、在胎期間に比べて体重が低い子宮内発育遅延児(SGA)が、出生後に栄養環境が良いために体重が急速に伸び早期に標準に追いつくことによって、将来的に肥満となる可能性が示されています(Eriksson, 2001)。子宮の中で飢饉と飢餓状態を体験し、それが続いても大丈夫なように身体作りをして生まれ出ると、正反対のファーストフードとコンビニの飽食環境です。母親が自分の美容のためにダイエットを続けることは、自分の子どもが肥満に、生活習慣病になる可能性があるのです。なんとも皮肉なことだと思いませんか。
さらに、痩せすぎたら早く病気になって寿命が短くなるという、もっと衝撃的なデータが報告されています。
痩せすぎは寿命を縮める
どのようにして健康体重、健康なBMIが決められていると思いますか。それは科学的な手法を用いて、もっとも長寿である体重が決められているのです。それは長生きできる体重なのです。
メットライフ生命保険会社(Metropolitan Life Insurance Company)は1973年に、契約者のデータにもとづいて、もっとも死亡率が低い理想的な“ideal”身長と体重の組み合わせである標準身長・体重表を作成しました(Harrison, 1985)。その10年後の1983年に改訂されました(Harrison, 1985)。この標準身長・体重表が指標として欧米で広く使われていました。米国の摂食障害専門病棟でも、それが目標体重として使用されていました(永田利彦 ほか, 1998)。
ところが、先進諸国の栄養状態がよくなるにつれて、人々の身長が高くなり、この「標準身長・体重表」が合わなくなっていきました。そこでいくつかの指標、計算方法が検討されましたが、Ancel Keys(Keys, et al., 1972)がBMIを肥満度の指標として、他の指標に比べて有用であるとしました。その後World Health Organization(以下WHOと略す)が使用するようになって、広く使用されているようになっています。
WHOでは18.5~24.9を普通体重、25.0~29.9を過体重、30以上を肥満、18.5未満を痩せすぎとしています(World Health Organization, 1995)。しかし、1995年時点で、WHOが18.5未満を痩せすぎとした根拠になるデータは少なかったのです。先進諸国での関心は肥満です。栄養状態が良すぎることが問題でしたから、低体重による健康状態への悪影響のデータが少なかったのです。
1995年のWHOの報告書では、インドでBMIが18.5の男性は、10年間の追跡調査で有意に死亡率が上昇すること、16以下であると死亡率が3倍になるデータが紹介されています(World Health Organization, 1995)。また、バングラデシュやブラジルでの研究では、体重が低いと病気で仕事を休む日が有意に多くなることが示されています(World Health Organization, 1995)。
その後、先進諸国でもコホート研究が積極的に行われることになります。ここでいうコホート研究とは、ある地域住民を対象に、第1回の調査を行い、基礎的な健康情報を得た上で、とくに特別な治療などを行わずに、5年、10年の後に、同じ地域住民に対して第2回、第3回などの調査を行なう縦断研究を指します。そこでは、いろいろな要因が、その後の病気の発症などといったこととどのように関連しているか検討されます。何千から何万もの人を対象とし、何十年も追跡調査するので、非常にお金のかかる研究ですが、科学的な価値は非常に高いものとなります。
米国(Flegal, Graubard, Williamson & Gail, 2005)、中国(Gu, et al, 2006)、日本(Sasazuki et al, 2011)の中年以降の人々を対象とした、10年程度の縦断的な死病率研究、コホート研究では、Jカーブ(体重が上がれば追跡調査中の死亡率が上昇するが、痩せすぎの悪影響が認められない)ではなく、Uカーブ(痩せすぎでも、太りすぎでも追跡調査中の死亡率が上昇する)を示すことが明らかになっています。ただ、研究は20歳代を対象としたコホート研究はではありません。20歳から10年追跡調査しても、有害事象が生じにくく、研究として成り立たないことからです。
図3.米国での研究でのBMIと死亡の相対危険度。(Flegal KM et al. 2005を改編)
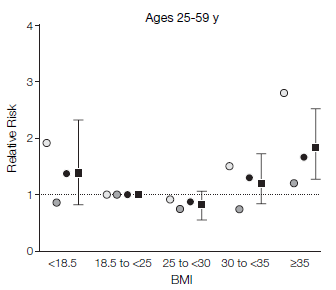
図4.中国、65歳未満を対象としたBMIと死亡の相対危険度(Gu D et al. 2006を改編)
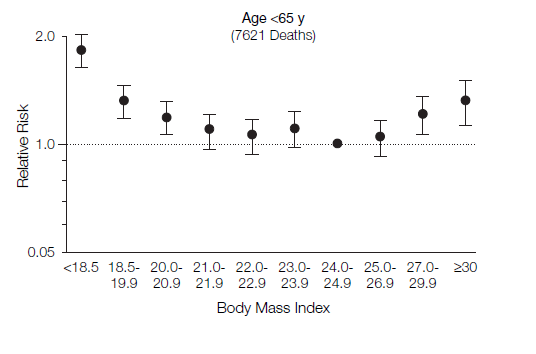
図5.中国、65歳以上を対象としたBMIと死亡の相対危険度(Gu D et al. 2006を改編)
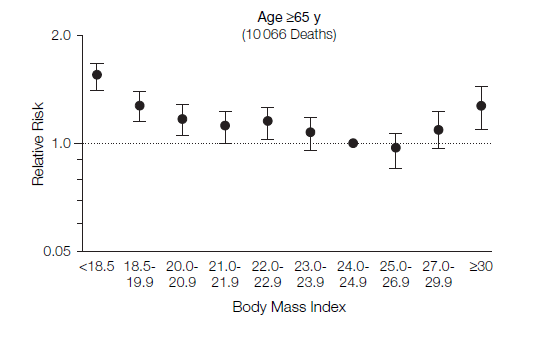
図6.日本での研究結果 (Sasazuki et al, 2011 https://epi.ncc.go.jp/can_prev/evaluation/2830.html)
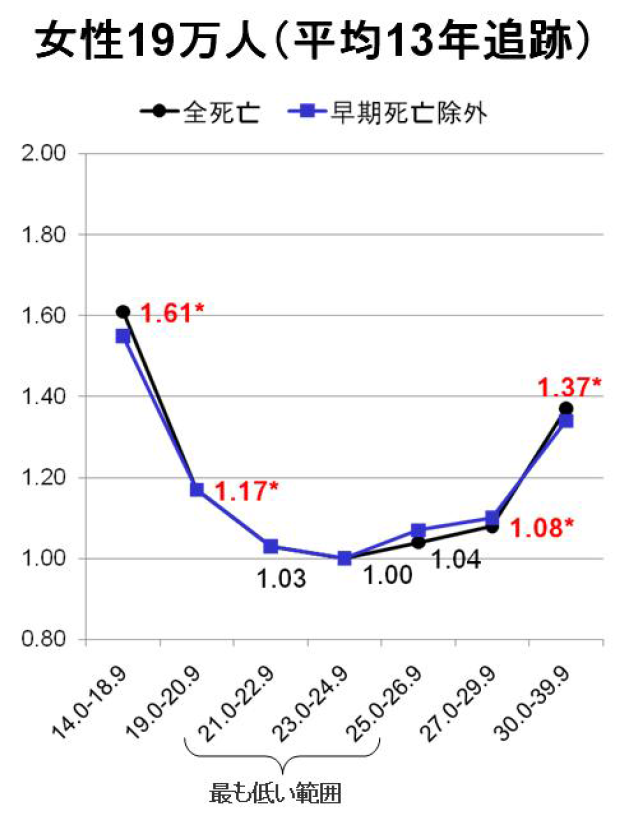
図4~6に、それらの研究結果を示しています。横軸がBMIの値です。縦軸がrelative risk相対危険度です。中国の65歳未満(40歳~64歳)を対象とした研究結果の図がわかりやすいですが(図5)、BMIが24.0~24.9に比べて、BMIが18.5未満では、相対危険度が2倍近いことが分かります。つまり、10年の追跡調査中、BMIが18.5未満であると、死亡率が倍近いということです。
さらに、最近の先進諸国での研究では、18.5未満を痩せすぎとするWHOの体重カテゴリーへの疑問が呈されるようになっています。貧困による栄養失調の可能性がほとんど無く、心臓血管系疾患のリスク要因への治療が十分に行きとどいた先進諸国では、過体重が死亡率上昇につながらないのです(医療費を押し上げているでしょうが)。
デンマークでの研究(Afzal, Tybjaerg-Hansen, Jensen & Nordestgaard, 2016)は、コペンハーゲンの20~100歳の一般人口を対象に、1976~1978年、1991~1993年、2003~2013年のコホートを、2014年11月まで追跡調査した結果を報告しています(追跡期間はそれぞれ19.8年、11.0年、4.6年で、3つのコホートのエントリー時の年齢中央値はそれぞれ54歳、61歳、58歳)。追跡調査期間が時期によって異なりますので、相対危険度ではなくハザート比が用いられており、いつそのことが起こったかも考慮にいれていますので、以下、追跡調査期間が異なる3つのコホートを比較するのに適しています。
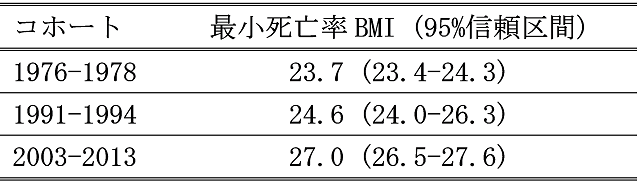
1976~1978年コホートでは、BMIが30以上であると、BMI18.5~24.9に比べ死亡のハザード比は1.31倍でしたが、2003~2013年コホートでは0.99倍と、過体重と関連しなくなりました(Afzal, Tybjaerg-Hansen, Jensen & Nordestgaard, 2016)。また、1976~1978年コホートでは、BMIが25~29.9の死亡は、BMIが18.5~24.9の死亡のハザード比では1.04倍でしたが、2003~2013年コホートでは0.86倍と、「過体重の死亡率の方が統計学的に有意に低い」という結果でした。さらに、もっとも死亡率が低いBMIは(表2)、1976~1978年コホートでは23.7、1991~1994年コホートでは24.6、2003~2013年コホートでは27.0と、「過体重」とされるBMIがもっとも死亡率が低かったのです(Afzal, Tybjaerg-Hansen, Jensen & Nordestgaard, 2016)。
図7.デンマークでの最小死亡率体重の上昇
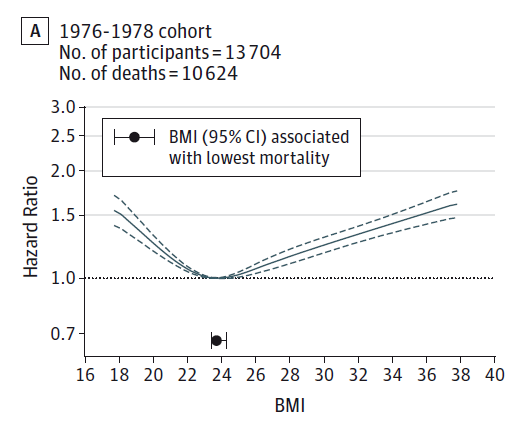
Afzal S et al. (2016) Change in Body Mass Index Associated With Lowest Mortality in Denmark, 1976-2013. JAMA, 315, 1989-1996.
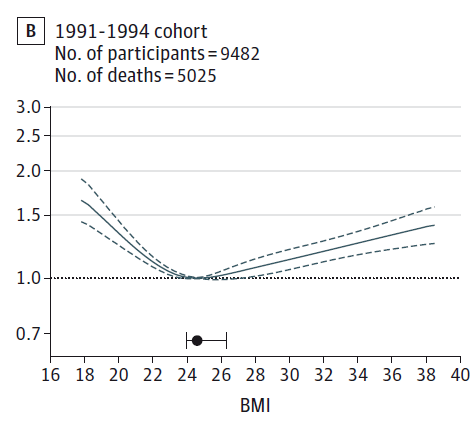
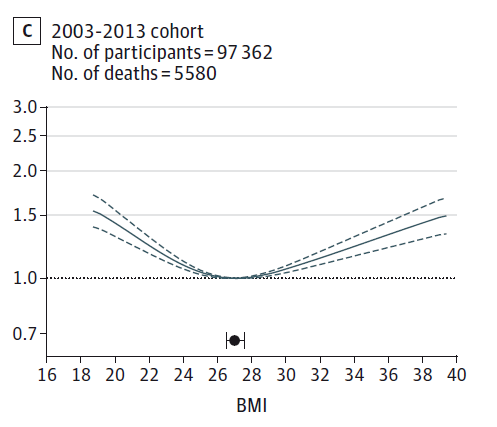
表1. デンマークでの最小死亡率体重の上昇
Afzal S et al. (2016) Change in Body Mass Index Associated With Lowest Mortality in Denmark, 1976-2013. JAMA, 315, 1989-1996.
日本の研究でも、BMIが21から26.9の間が追跡調査中、もっとも死亡率が低かったのです(Sasazuki et al, 2011)。このように治療環境が整った先進諸国では、過体重より低体重の健康リスクが上昇しているのです。過体重で生じる病態には治療薬がありますが、痩せすぎの治療は栄養補給、適切なカロリー摂取なのに、ダイエットに夢中で、それを自ら拒否している場合、どうすることもできません。
そして、もっとも死亡率が低いBMIが、当然、もっとも健康な体重ですが、あとで詳しくご紹介するように、20歳代の日本女性はシンデレラ体重、モデル体重を目指している結果、大多数の若年女性のBMIは21以下となっており、不健康と言わざるを得ません。
このように痩せすぎに対する健康被害のデータは限定的で、美容目的でのダイエットを引き留めるだけの迫力に欠けていました。体重が下がって生理が止まっても、それを気にするのは周りの親兄弟だけで、ご本人は気にしていないことがほとんどです。
骨粗鬆症、骨折といっても、それは40歳以降のことで、今だけで必死なご本人は気にかけてくれません。体重と寿命に関するコホート研究のほとんどは、中年以降が対象であり、若年者がカロリー制限をすると寿命が縮まるという「決定的証拠」はありませんでした。しかし、「食べたいだけ食べる」のが悪いのは、中高年に限定される可能性が、「アカゲザル」研究で分かってきたのです。
アカゲザルが示してくれた、若年からのカロリー制限の危険性
カロリー制限(食べたいだけ食べさせないことです。ダイエットは減量しようとする努力で、実際に減量できたかどうか無関係です。実験的に、強制的に実験動物に与える食餌を制限してしまったことです)は、年齢上昇とともに生ずる種々の障害を遅らせる効果、アンチエイジング効果があるとされていました。現実に、ハエ、ミジンコ、魚、マウスといった寿命の短い生物では、カロリー制限の結果、寿命が長くなるという研究結果が一致していました(Ingram, et al, 1990)。
一方、寿命がずっと長い人類ではどうなのか、疑問が残っていました。そこで、カロリー制限のアンチエイジング効果を証明しようと、寿命という観点から、人類とげっ歯類の中間に位置する霊長類のアカゲザルを対象に実験が行われました。アカゲザルの寿命の中央値は26年です。日本人の寿命の中央値は80歳を超えていますので、正確には中間ではないかもしれません。この研究は米国の2つの研究機関が独立して実施しました(これは科学的研究でよく使われる言い回しで、それぞれが協議せずに実験を行うことで、だれがやっても同じ結果になるかどうかという視点で科学的に重要なのです)。
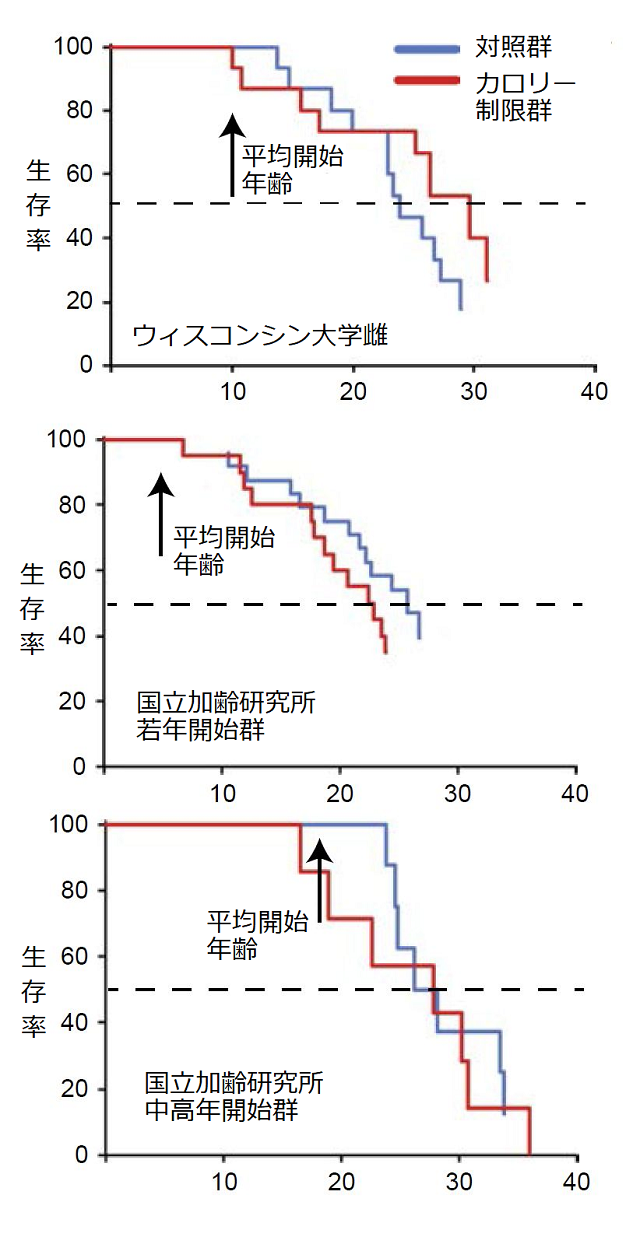
1987年から米国の国立加齢研究所(National Institute on Aging)、1989年からウィスコンシン大学(University of Wisconsin)で、アカゲザルに好きなだけ食べさせる群と、低栄養にならないように十分に注意しつつ、それよりもカロリーを3割減らした餌を与える群(カロリー制限群)に分け、種々の生活習慣病が発症するかどうか、最終的には生存率を比較しました。その結果、ウィスコンシン大学ではカロリー制限群の生存率が高く、長寿であったのに、国立加齢研究所ではカロリー制限の効果が認められませんでした。
長寿、アンチエイジングを研究する研究者の間で議論となっていました。じつはカロリー制限開始年齢が大きなポイントだったのです。図8には雌群だけを示しましたが、両研究を付き合わせて検討すると、カロリー制限開始の年齢に違いがあり、ウィスコンシン大学ではカロリー制限開始年齢が7~15歳(猿の大人の年齢)なのに対し、国立加齢研究所は1~23歳と幅広かったのです。
そこで、2015年までの国立加齢研究所のデータ(開始後28年程度)を、実験開始時年齢によって若年開始群(1~14歳)と中高年開始群(16~23歳)に分けて解析すると、中高年で始めた場合は長寿効果がみられ、研究期間のどの時点でも対照群の死亡率はカロリー制限中高年開始群の約2倍で、中高年からのカロリー制限は長寿効果がありました(図8の一番下のグラフです)。
一方で、国立加齢研究所のカロリー制限若年開始群では、寿命が延びる効果が認められなかっただけではなく、80%の死病率には、対照群よりカロリー制限若年開始群の方が早く到達し、統計学的有意に達していないものの、雌群ではより明確でした(図8は雌群のみ)(Mattison, et al, 2017)。若年から栄養失調にならない程度のカロリー制限を続けると寿命が短くなるという、アンチエイジングと正反対の結果となってしまったのです。
アカゲザルの寿命は長く、寿命の中央値が26年で、希に40歳に達することがあると言います。ですので、この30年に及ぶ研究でも、若年開始群の38%がまだ生存しており、結論には達していません。アカゲザルは寿命という観点でマウスと人類の中間に位置し、より寿命の長い人類でも、中高年で食べられるだけ食べるのが良くないのは当然ですが、若年からカロリー制限(食べたいだけ食べるのから3割減)を始めることは、寿命を縮める影響がアカゲザルより大きい可能性があります(Mattison et al, 2017)。よく考えれば当然のことです。
それでも見た目重視で、あなたは不健康なダイエット、無理な減量をするのでしょうか。次回以降、不健康なダイエットの広がりを紹介します。
図8. ウィスコンシン大学と米国の国立加齢研究所アカゲザルカロリー制限実験の長寿に対する効果(雌群のみを紹介)(Mattison JA et al. 2017を改編)
文献
・Afzal, S., Tybjaerg-Hansen, A., Jensen, G. B. & Nordestgaard, B. G. (2016) Change in Body Mass Index Associated With Lowest Mortality in Denmark, 1976-2013. JAMA, 315, 1989-1996.
・Barker, D. J. & Osmond, C. (1986) Infant mortality, childhood nutrition, and ischaemic heart disease in England and Wales. Lancet, 1, 1077-1081.
・Barker, D. J., Winter, P. D., Osmond, C., Margetts, B. & Simmonds, S. J. (1989) Weight in infancy and death from ischaemic heart disease. Lancet, 2, 577-580.
・Canadian Paediatric Society (2004) Dieting in adolescence. Paediatr Child Health, 9, 487-503.
・Eriksson, J. (2001) Commentary: Early ‘catch-up’ growth is good for later health. International Journal of Epidemiology, 30, 1330-1331.
・Flegal, K. M., Graubard, B. I., Williamson, D. F. & Gail, M. H. (2005) Excess deaths associated with underweight, overweight, and obesity. JAMA, 293, 1861-1867.
・Gluckman, P. D. & Hanson, M. A. (2004) Living with the past: evolution, development, and patterns of disease. Science, 305, 1733-1736.
・Gu, D., He, J., Duan, X., Reynolds, K., Wu, X., Chen, J., et al (2006) Body weight and mortality among men and women in China. JAMA, 295, 776-783.
・Han, Z., Mulla, S., Beyene, J., Liao, G., McDonald, S. D. & Knowledge Synthesis, G. (2011) Maternal underweight and the risk of preterm birth and low birth weight: a systematic review and meta-analyses. International Journal of Epidemiology, 40, 65-101.
・Harrison, G. G. (1985) Height-weight tables. Annals of Internal Medicine, 103, 989-994.
・Iketani, T., Kiriike, N., Stein, M. B., Nagao, K., Nagata, T., Minamikawa, N., et al (2003) Effect of menatetrenone (vitamin K2) treatment on bone loss in patients with anorexia nervosa. Psychiatry Research, 117, 259-269.
・Ingram, D. K., Cutler, R. G., Weindruch, R., Renquist, D. M., Knapka, J. J., April, M., et al (1990) Dietary restriction and aging: the initiation of a primate study. Journal of Gerontology, 45, B148-163.
・伊東宏 (2015) 子宮内膜環境と将来のメタボリック症候群 DOHaDの観点から 妊婦のエネルギー摂取不足と児が将来脂肪肝を発症するリスクの関わりについて. 日本内分泌学会雑誌, 91, 176.
・河原田洋次郎, 永田利彦, 切池信夫, 池谷俊哉, 田中秀樹 & 山上榮 (2000) 神経性食思不振症経過中に骨折を起こした3症例. 精神医学, 42, 847-850.
・健康局健康課栄養指導室栄養調査係 (2016) 平成27年国民健康・栄養調査: 厚生労働省,.
・Keys, A., Fidanza, F., Karvonen, M. J., Kimura, N. & Taylor, H. L. (1972) Indices of relative weight and obesity. Journal of Chronic Diseases, 25, 329-343.
・Kubota, K., Itoh, H., Tasaka, M., Naito, H., Fukuoka, Y., Muramatsu Kato, K., et al (2013) Changes of maternal dietary intake, bodyweight and fetal growth throughout pregnancy in pregnant Japanese women. Journal of Obstetrics and Gynaecology Research, 39, 1383-1390.
・丸山史, 内海厚, 吉沢正彦 & 本郷道夫 (2000) 摂食障害患者と無月経 BMIを指標とした予後調査より. 思春期学, 18, 177-181.
・Mattison, J. A., Colman, R. J., Beasley, T. M., Allison, D. B., Kemnitz, J. W., Roth, G. S., et al (2017) Caloric restriction improves health and survival of rhesus monkeys. Nature Communications, 8, 14063.
・Nagata, T., Saito, M., Kawarada, Y. & Kiriike, N. (2003) A case of childhood onset anorexia nervosa developing femoral neck fracture and osteoporosis. Jpn J Child Adolesc Psychiatr, 44 (Supplement), 94-100.
・永田利彦 & 切池信夫 (1998) 米国における摂食障害患者の治療の現況:COPE病棟(ピッツバーグ大学摂食障害専門病棟)での重症患者の治療経験から. 精神医学, 40, 781-785.
・永田利彦, 山下達久, 山田恒, 水原祐起, 水田一郎, 野間俊一, 田中聡, 崔炯仁, 和田良久, 岡本百合, 鈴木眞理 & 宮岡等 (2018) 無視されてきたダイエットと痩せすぎの危険性 -痩せすぎモデル禁止法に向けて-. 精神神経学雑誌, 120, 741-751.
・Sasazuki, S., Inoue, M., Tsuji, I., Sugawara, Y., Tamakoshi, A., Matsuo, K., et al (2011) Body Mass Index and Mortality From All Causes and Major Causes in Japanese: Results of a Pooled Analysis of 7 Large-Scale Cohort Studies. Journal of Epidemiology, 21, 417-430.
・瀧本秀美, 吉池信男 & 加藤則子 (2010) 【胎生期環境と生活習慣病】 わが国における低出生体重児の増加とその要因 母子保健統計を用いた検討. 医学のあゆみ, 235, 817-821.
・Wardle, J., Haase, A. M. & Steptoe, A. (2006) Body image and weight control in young adults: international comparisons in university students from 22 countries. International Journal of Obesity, 30, 644-651.
・Weaver, C. M., Gordon, C. M., Janz, K. F., Kalkwarf, H. J., Lappe, J. M., Lewis, R., et al (2016) The National Osteoporosis Foundation’s position statement on peak bone mass development and lifestyle factors: a systematic review and implementation recommendations. Osteoporosis International, 27, 1281-1386.
・World Health Organization (1995) Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee (Technical Report Series No. 854). Geneva: World Health Organization,.
プロフィール

永田利彦
大阪市立大学大学院を修了後、大阪市立大学大学院医学研究科神経精神医学教室講師、准教授、ピッツバーグ大学客員准教授などを経てH25年なんば・ながたメンタルクリニックを開設。医学博士、精神科専門医、精神保健指定医、精神保健判定医、Academy for Eating Disorders、Research Society for Eating Disorder、日本摂食障害学会理事。日本不安症学会、日本うつ病学会、日本生物学的精神医学会、日本精神科診断学会などの学会の評議員。日本摂食障害学会監修・摂食障害治療ガイドライン(2012)の代表編者の1人。摂食障害、不安障害、パーソナリティ障害、気分障害に関する論文、総説多数。

山田恒


